朱鸿源、刘小翕的研究工作被 Biophysical Journal 接收
- 发布时间:
- 2025-05-05
- 文章标题:
- 朱鸿源、刘小翕的研究工作被 Biophysical Journal 接收
- 内容:
上皮-间质转化(EMT)是癌症转移和器官纤维化等疾病中的关键生物过程,其核心特征是细胞黏附分子的“换岗”:上皮细胞中的E-钙黏素被间充质细胞的N-钙黏素所替代,导致细胞间黏附削弱、细胞迁移性增强。这一过程虽已被广泛关注,但EMT如何通过分子力学机制削弱细胞黏附力、进而推动疾病进展,长期以来尚未完全阐明。
朱鸿源助理教授和硕士生刘小翕等创新性地开发了“晶格-离合器”理论模型,结合原子力显微镜(AFM)实验,揭示了EMT中钙黏素交换所引发的多层级黏附弱化机制。研究发现,N-钙黏素不仅单分子断裂力显著低于E-钙黏素,其膜上聚集能力亦较差,尤其在高刚度基质上黏附显著减弱。与此同时,EMT还通过降低皮层张力、扰乱钙黏素团簇,进一步削弱细胞间和细胞-基质黏附。这项研究系统描绘了EMT如何在分子、团簇和细胞整体层面重构黏附微环境,揭示了癌细胞黏附力学弱化的全新机制。
该研究建立了一个集成钙黏素聚集、皮层张力调控与细胞黏附力学的“晶格-离合器”模型,提出皮层张力对黏附稳定性具有双重作用:适度张力能促进钙黏素的聚集和稳定,但张力过高反而会削弱黏附。研究还发现,EMT使细胞处于低张力状态,从而减少钙黏素团簇的力学稳定性,加速细胞间黏附断裂。这一机制不仅解释了癌细胞在EMT中获得的高迁移性的根本原因,为理解胚胎发育、纤维化等生理与病理过程中的组织重塑提供了新视角。
该成果以“上皮-间质转化中细胞间黏附重构的钙黏素动力学与皮层张力调控机制”(Cadherin Dynamics and Cortical Tension in Remodeling Cell-Cell Adhesion During EMT)为题,发表在国际著名生物物理学期刊《生物物理杂志》(Biophysical Journal)上。西安交通大学生物医学信息工程教育部重点实验室为论文第一作者单位和通讯作者单位,助理教授朱鸿源和硕士生刘小翕为共同第一作者,林敏教授为通讯作者。该研究得到了国家自然科学基金、中国博士后科学基金、陕西省青年拔尖人才支持计划等项目资助,并得到了西安交通大学分析测试共享中心的大力支持。
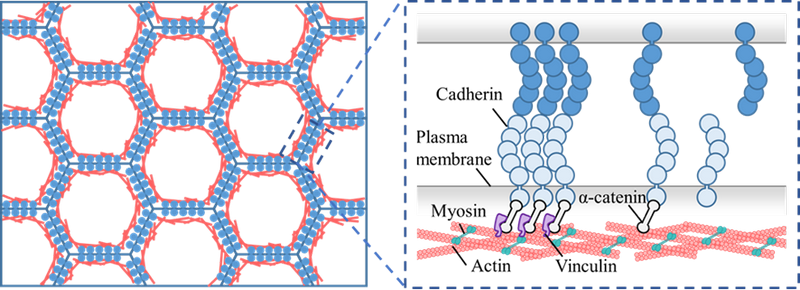
图1. 细胞间黏附中的主要分子结构
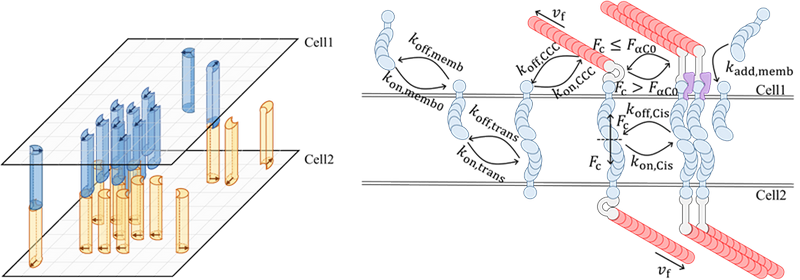
图2. 描述细胞间黏附动力学的“晶格-离合器”理论模型






