张政、刘小翕的研究工作被 Nano Letters 接收
- 发布时间:
- 2025-03-04
- 文章标题:
- 张政、刘小翕的研究工作被 Nano Letters 接收
- 内容:
细胞通过力学敏感的受体(整合素)与其特异性配体结合,并主动施加牵张力,从而感知并响应细胞外基质的刚度,最终影响细胞的迁移、增殖和分化等关键过程。传统生物材料通过共价键固定配体耦合强度,难以模拟生理环境中配体-受体键的动态力学特性(如键合力12-56 pN范围可调)。研究团队在《Nano Letters》发表最新研究,提出基于DNA分子力学的“张力调控平台”(Tension Gauge Tether, TGT),实现整合素-配体耦合强度的定量精确调控,并揭示细胞通过cofilin磷酸化-肌动蛋白聚合反馈环路动态适应力学微环境甚至改变迁移方向的力学-生化耦合机制。
研究团队基于DNA双链解链力与几何构型的力学特性(图1),设计了两类DNA分子弹簧—双链DNA(dsDNA)和茎环DNA(slDNA),二者均可承受43 pN的临界张力(Ttol=43 pN),但断裂后行为截然不同:dsDNA断裂会导致RGD配体脱落,而slDNA断裂后仍能保留配体。实验发现,在dsDNA平台,细胞在刚度阈值(5 kPa)以上主动降低牵引力,抑制黏着斑生长、抑制转录因子YAP入核来减少力学信号传导,从而避免DNA断裂;而在slDNA平台,细胞则增强肌动蛋白聚合,促进黏着斑成熟。进一步机制研究表明,这一适应性行为依赖于cofilin蛋白的磷酸化调控细胞骨架:在dsDNA平台,cofilin磷酸化水平降低,抑制肌动蛋白聚集,防止张力超载导致DNA断裂。而在slDNA平台,细胞通过talin蛋白构象展开增强黏附力传导。在刚度梯度基质上,细胞迁移方向会因耦合强度不同发生逆转。传统“正向趋硬性”(向高硬度区域迁移)在slDNA平台上得以保留,但在dsDNA平台上则转变为“负向趋硬性”—细胞主动逃离高硬度区域,以规避配体脱落风险。这一现象首次证实了配体耦合强度是决定细胞迁移方向的关键物理参数。
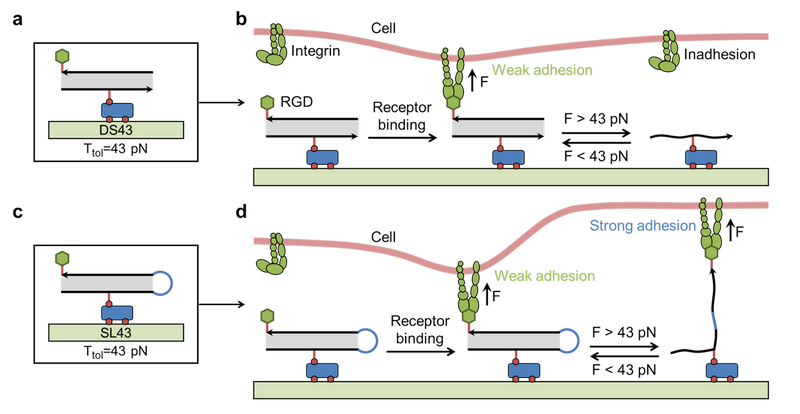
图1.在dsDNA基底,当整合素与RGD结合产生的拉力超过43 pN时,RGD将从基质表面解离,导致细胞无法黏附;若作用力低于43 pN,细胞则维持弱黏附状态。在slDNA基底,当整合素-RGD作用力超过43 pN时,茎环构象被打开但RGD仍锚定在基质上,使细胞保持强黏附状态;若作用力低于43 pN,细胞呈现相对较弱的黏附状态。
研究团队通过基于DNA分子张力调控平台的界面耦合强度调控策略,发现细胞黏附力-刚度耦合触发细胞力学自适应行为的反馈通路。该研究为力学生物学提供了两大范式突破:通过DNA分子设计实现配体-受体键强度量化调控,为仿生材料界面力学设计提供新思路;揭示细胞通过内部应力场与外部刚度场匹配实现细胞力学自适应理论。就好比钢琴家需要控制按键力度才能演奏完美乐章,细胞也需要‘感知’自身对基质的‘抓握力度’—而我们现在找到了调控这份‘触觉’的分子琴弦。
链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.4c05199






